協和発酵「ヒトミルクオリゴ糖」製造菌株安全性審査通過
執筆者:shirai
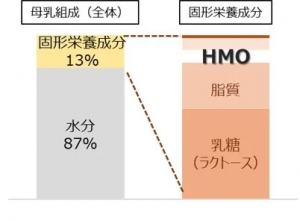 キリンホールディングスの子会社である協和発酵バイオは、HMO (Human Milk Oligosaccharide: ヒトミルクオリゴ糖) 3品目の製造に用いる菌株が、中国農業農村部(The Ministry of Agriculture and Rural Affairs of The People’s Republic of China, MARA )の安全性審査に合格したことを確認した。同社は、中国市場で粉ミルクに使用される成分として、2FL(2’-fucosyllactose)、3SL(3’-sialyllactose)、6SL(6’-sialylllacotse)3品目のHMOの発売を目指している。中国市場でHMOを発売するためには、1段階目としてHMOの製造菌株の安全性審査に合格する必要がある。今回、同社は、3品目それぞれの製造菌株の安全性審査を通過したことを受け、次なる審査への申請を進めている。また世界各国での販売に向けて、FDA(米国食品医薬品局)へのGRAS1(Generally Recognized as Safe)通知や、欧州委員会への新規食品申請、アジア・オセアニア諸国での承認申請も開始している。同社は2000年に世界で初めて工業レベルで大量生産が可能なHMO生産システムを構築し、2022年11月には、タイに新設した工場でHMO3品目の商業生産を開始。今後、新規食品原料の申請が承認された国・地域で、順次上市していく予定となっている。「ヒトミルクオリゴ糖(HMO)」とは 母乳に含まれるオリゴ糖の総称。母乳中の固形成分の中で、ラクトース、脂質に次ぐ、三番目に多い成分で、これまでに200種類以上のHMOが母乳から発見されている。牛乳や他哺乳類由来の乳にはほとんど含まれず、特にヒトの初乳に多く含まれることから、乳幼児にとって重要な成分であることが知られている。HMO入り粉ミルク市場は欧米で継続的に伸長しているだけでなく、人口増加が見込まれる中国・東南アジア地域でも消費拡大が期待されており、今後の年平均成長率は20%~30%程度と予測されている。
キリンホールディングスの子会社である協和発酵バイオは、HMO (Human Milk Oligosaccharide: ヒトミルクオリゴ糖) 3品目の製造に用いる菌株が、中国農業農村部(The Ministry of Agriculture and Rural Affairs of The People’s Republic of China, MARA )の安全性審査に合格したことを確認した。同社は、中国市場で粉ミルクに使用される成分として、2FL(2’-fucosyllactose)、3SL(3’-sialyllactose)、6SL(6’-sialylllacotse)3品目のHMOの発売を目指している。中国市場でHMOを発売するためには、1段階目としてHMOの製造菌株の安全性審査に合格する必要がある。今回、同社は、3品目それぞれの製造菌株の安全性審査を通過したことを受け、次なる審査への申請を進めている。また世界各国での販売に向けて、FDA(米国食品医薬品局)へのGRAS1(Generally Recognized as Safe)通知や、欧州委員会への新規食品申請、アジア・オセアニア諸国での承認申請も開始している。同社は2000年に世界で初めて工業レベルで大量生産が可能なHMO生産システムを構築し、2022年11月には、タイに新設した工場でHMO3品目の商業生産を開始。今後、新規食品原料の申請が承認された国・地域で、順次上市していく予定となっている。「ヒトミルクオリゴ糖(HMO)」とは 母乳に含まれるオリゴ糖の総称。母乳中の固形成分の中で、ラクトース、脂質に次ぐ、三番目に多い成分で、これまでに200種類以上のHMOが母乳から発見されている。牛乳や他哺乳類由来の乳にはほとんど含まれず、特にヒトの初乳に多く含まれることから、乳幼児にとって重要な成分であることが知られている。HMO入り粉ミルク市場は欧米で継続的に伸長しているだけでなく、人口増加が見込まれる中国・東南アジア地域でも消費拡大が期待されており、今後の年平均成長率は20%~30%程度と予測されている。